细胞状态转化广泛发生于多种生物过程比如分化和重编程。作为由许多基因组成的复杂调控网络控制的动力学系统,细胞如何协调基因表达簇的切换对于状态转化至关重要。单细胞基因组学技术的进步使得在高维基因空间刻画细胞状态转化的动力学成为可能。
细胞通常通过状态特异性基因相互激活来维持特定的状态,同时抑制与其他状态对应的基因表达。在某种意义上,这类似于自旋系统分隔成向上和向下的区域。当发生细胞状态转化时,基因需要切换其表达状态,类似于翻转一些向上和向下的自旋区域(图1)。
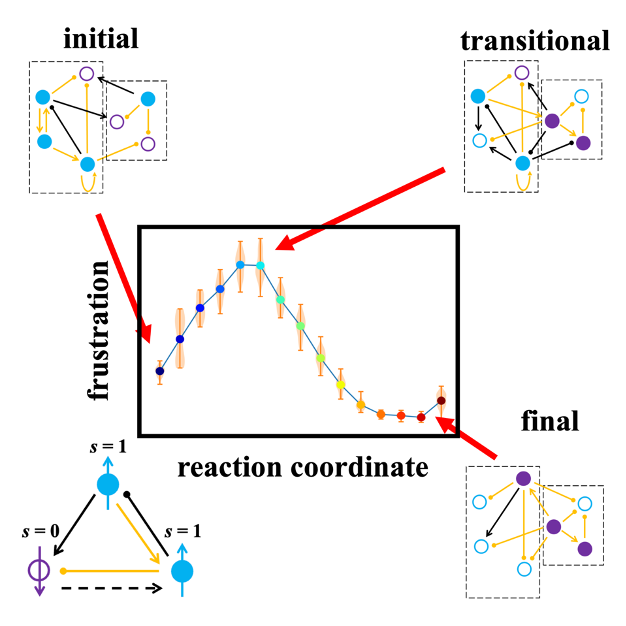
图1. 细胞状态转化在初末态基因调控网络模块间相互作用较弱,阻错较小;中间状态相互作用较强,阻错达到峰值。
本研究通过将细胞状态转化与化学反应之间类比,分析了若干种不同细胞状态转化过程。对于每个过程,重建了描述转化进程的反应坐标,并推断了沿该反应坐标的基因调控网络。在所有过程中,观察到一个共同模式:不同基因调控模块之间的总体有效调控数量和强度先增加后减少,即过程中出现暂时的峰值。这种暂时的峰值体现了细胞状态转化中基因的协同性。
阻错是自旋玻璃中的重要概念,引申到基因调控网络中,阻错定义为基因接收到的调控与其表达状态之间的总体冲突。在细胞状态转化过程中,基因调控网络的阻错同样表现出先升高后下降的趋势。处于阻错峰值的细胞状态对应于化学反应中的过渡态。在化学反应中过渡态通常指反应坐标上的动力学瓶颈。尽管尚不清楚在相关的细胞表型转变过程中,它是否确实是一个动力学瓶颈,但将高阻错的中间细胞状态识别为“过渡态”是很有吸引力的,比如识别过渡态也与识别各种疾病的早期预警信号有关。
研究动力学系统如何在相应的状态空间中从一个稳定吸引子过渡到新的吸引子是极其重要的科学问题。本研究不仅揭示了细胞状态转化的一些普遍特征,同时借助统计物理和物理化学中的方法为细胞转化研究提供了新的视角。
这项研究成果近日在 PRX LIFE上发表,中国科学院理论物理研究所副研究员王维康为论文第一作者和共同通讯作者,匹兹堡大学邢建华教授是论文的共同通讯作者。这一工作得到了国家自然科学基金理论物理专款的支持。

正文链接(点击文末“阅读原文”直接跳转):
https://journals.aps.org/prxlife/abstract/10.1103/PRXLife.2.043009